C’est une recherche porteuse d’espoir dans le traitemement du cancer. Pour s’orienter dans le corps et s’installer dans certains organes, les cellules tumorales sont aidées par des protéines. Une équipe louvaniste vient de valider une méthode permettant leur identification.
Pourquoi un cancer du sein métastase-t-il dans le cerveau, mais jamais dans le lobe de l’oreille ou dans le petit orteil? L’équipe de Pierre Sonveaux, directeur de recherche FNRS à l’Institut de recherche expérimentale et clinique (Irec) de l’UCLouvain, a identifié une protéine responsable de la migration dans le cerveau de cellules tumorales de cancer du sein triple négatif (lire encadré plus bas). La validation de cette stratégie expérimentale ouvre la voie à de grands espoirs de parvenir à empêcher l’implantation de métastases cérébrales, hépatiques, pulmonaires et osseuses dans le cas de cancers du sein, de la prostate et du pancréas.
Un senseur particulier indique à chaque cellule cancéreuse sa situation géographique au sein du corps.
Lors du développement d’un cancer, les cellules tumorales prolifèrent. Elles se multiplient si vite que leur environnement leur devient rapidement hostile: outre son acidité, il se caractérise par un manque d’oxygène et de nutriments. Or, ces éléments sont à la base de la survie des cellules tumorales. S’en suit une compétition entre elles pour acquérir ces ressources. Certaines perdent ce combat et, affamées, quittent l’organe pour survivre. Véhiculées par le réseau sanguin, elles s’arrêteront et s’implanteront dans un autre organe, correspondant à leurs besoins. Si elles manquent de glucose ou de lipides, elles prendront leurs quartiers dans le cerveau. Si elles ont besoin d’acides aminés, elles iront dans le foie. Si elles ont souffert du manque d’oxygène, le poumon sera l’organe idéal pour migrer. Enfin, elles s’implanteront dans les os si elles ont besoin de calcium et de phosphate. Ces colonies de cellules cancéreuses, à distance de la tumeur d’origine, portent le nom de «métastases».
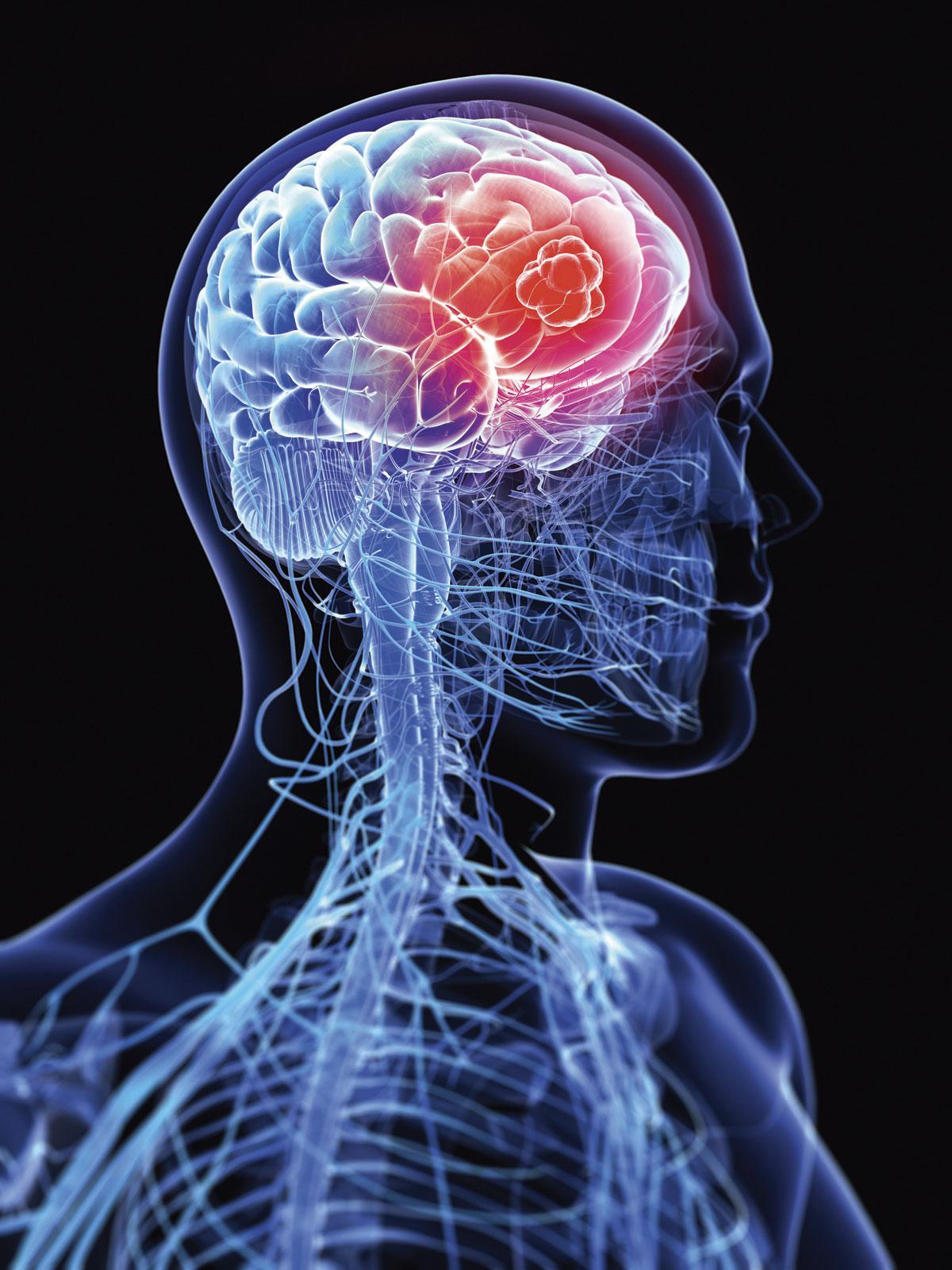
Comment ces cellules tumorales sont-elles au courant que l’organe qu’elles traversent est le milieu idéal où s’implanter pour combler leurs besoins? C’est l’objet de la découverte de l’équipe de Pierre Sonveaux. «C’est un senseur particulier qui indique à chaque cellule cancéreuse sa situation géographique au sein du corps», précise-t-il.
Lire aussi | Cancer avancé du sein: une nouvelle arme efficace
Cancer du sein et métastases au cerveau
Comme modèle, les chercheurs ont utilisé le cancer du sein triple négatif. Ce cancer particulièrement agressif représente 15% des cancers du sein en Belgique. Il est prompt à coloniser d’autres organes et à y former des métastases. Les options thérapeutiques pour le combattre étant rares et souvent peu efficaces, il est accompagné d’un sombre pronostic, avec un taux de survie à cinq ans d’environ 20%.
«Comme organe de destination, pour nos premiers travaux, nous avons choisi de nous concentrer sur le cerveau, car c’est l’endroit où les métastases affectent le plus la qualité de vie.» Afin d’identifier le senseur informant la cellule tumorale qu’elle traverse le cerveau, la stratégie expérimentale de l’équipe louvaniste a été de rendre, chez la souris, des cellules du cancer du sein humain triple négatif exclusivement avides pour le cerveau. «Une approche génétique a ensuite révélé la nature du senseur: il s’agit d’une protéine impliquée dans l’alimentation cellulaire, dénommée Cox7b. Elle était présente dans toutes les cellules tumorales métastasées dans le cerveau et absente chez celles qui ne colonisaient pas cet organe. Dans un deuxième temps, forts de cette découverte, nous avons enlevé cette protéine en utilisant une approche expérimentale. Résultat: aucune métastase n’était présente dans le cerveau!»
Cox7b: le grand responsable
Pour établir un lien de cause à effet, une étape supplémentaire a été réalisée: les chercheurs ont ajouté la protéine Cox7b à des cellules cancéreuses qui n’allaient normalement pas dans le cerveau. Résultat? «Elles y sont allées! Avec ces deux expériences, nous avons une démonstration absolue que Cox7b est responsable de l’implantation des métastases dans le cerveau, dans le cas du cancer du sein triple négatif», indique Pierre Sonveaux. C’est un énorme pas en avant.
«Cette stratégie étant désormais validée, elle sera utilisée pour identifier les protéines qui permettent aux métastases de s’installer dans le foie, dans le poumon et dans les os. Et ce, dans le cas du cancer du sein triple négatif, mais aussi dans celui du cancer de la prostate (NDLR: le plus courant chez l’homme avec 9 706 personnes diagnostiquées en 2020) et du pancréas (NDLR: extrêmement meurtrier avec moins de 13% de chances de survie endéans les cinq ans).»
Cette recherche est financée par Welbio, le cluster d’excellence scientifique de la Région wallonne visant la valorisation des résultats en applications pharmaceutiques. «A cours des prochaines années, nous espérons découvrir toute une série de protéines responsables de l’implantation de métastases dans certains organes, parmi lesquelles certaines pourraient être bloquées avec un médicament. Pour ce faire, il est impératif que ces protéines soient des enzymes. Ce n’est malheureusement pas le cas de la protéine Cox7b, mais bien de certaines protéines que nous avons récemment identifiées comme étant les senseurs permettant aux cellules cancéreuses de métastaser dans le foie, dans le cas du cancer du pancréas. La validation de ces résultats est en cours.» Avec de grands espoirs à la clé.