Armer le système immunitaire pour éliminer les tumeurs : les oncologues observent des résultats sans précédents dans des cancers jusqu’ici incurables. Même moins performante sur le cancer du sein ou de la prostate, même ne fonctionnant que sur une minorité de patients, l’immunothérapie est déjà reconnue comme une « révolution thérapeutique ».
L’immunothérapie est devenue la star des congrès mondiaux sur le cancer. Depuis 2015, elle fait la Une de la Société américaine d’oncologie clinique (Asco), le plus grand séminaire international consacré à la maladie, celui qui donne le ton. A chaque édition, on y présente de nouvelles molécules, dessinant de nouveaux espoirs. Et jamais on ne s’y est montré si optimiste et fasciné que lors de ces dernières sessions. A juste titre. Parce que, cette fois, les progrès sont là, réels, parfois spectaculaires et inespérés. L’Assemblée Nobel de l’Institut Karolinska à Stockholm qualifie même l’approche de » révolution « , lorsqu’elle décerne, en octobre dernier, son prestigieux prix de médecine à deux chercheurs, l’un américain, James Allison, l’autre japonais, Tasuku Honjo. Les deux lauréats ont découvert une nouvelle façon de combattre les tissus cancéreux, non pas en ciblant la tumeur, mais en armant le système immunitaire du malade.

Les prémices
Cette idée centenaire – tenter de faire régresser la maladie grâce à une stimulation du système immunitaire – a donc fini par déboucher sur l’invention de médicaments à l’efficacité inédite, du moins dans certains cancers et chez un certain nombre de patients. Ça marche enfin ! Même si, le jour de la cérémonie des Nobel, dans la communauté de ceux qui soignent le cancer, on se disait un peu attristé de ne pas voir figurer sur le cliché officiel le Belge Thierry Boon, né en 1944 et aujourd’hui retraité. Oublié ou sous-estimé. Une raison majeure plaidait pour lui : la primauté de son travail. Il y a plus de trente ans, Thierry Boon fut le tout premier à se lancer sur la bonne piste. C’est dans son laboratoire, au début des années 1980, qu’a été mise en évidence l’existence d’antigènes tumoraux. Et de ses travaux pionniers allait émerger le concept de l’immunothérapie.
Cette idée centenaire a fini par déboucher sur l’invention de médicaments à l’efficacité inédite.
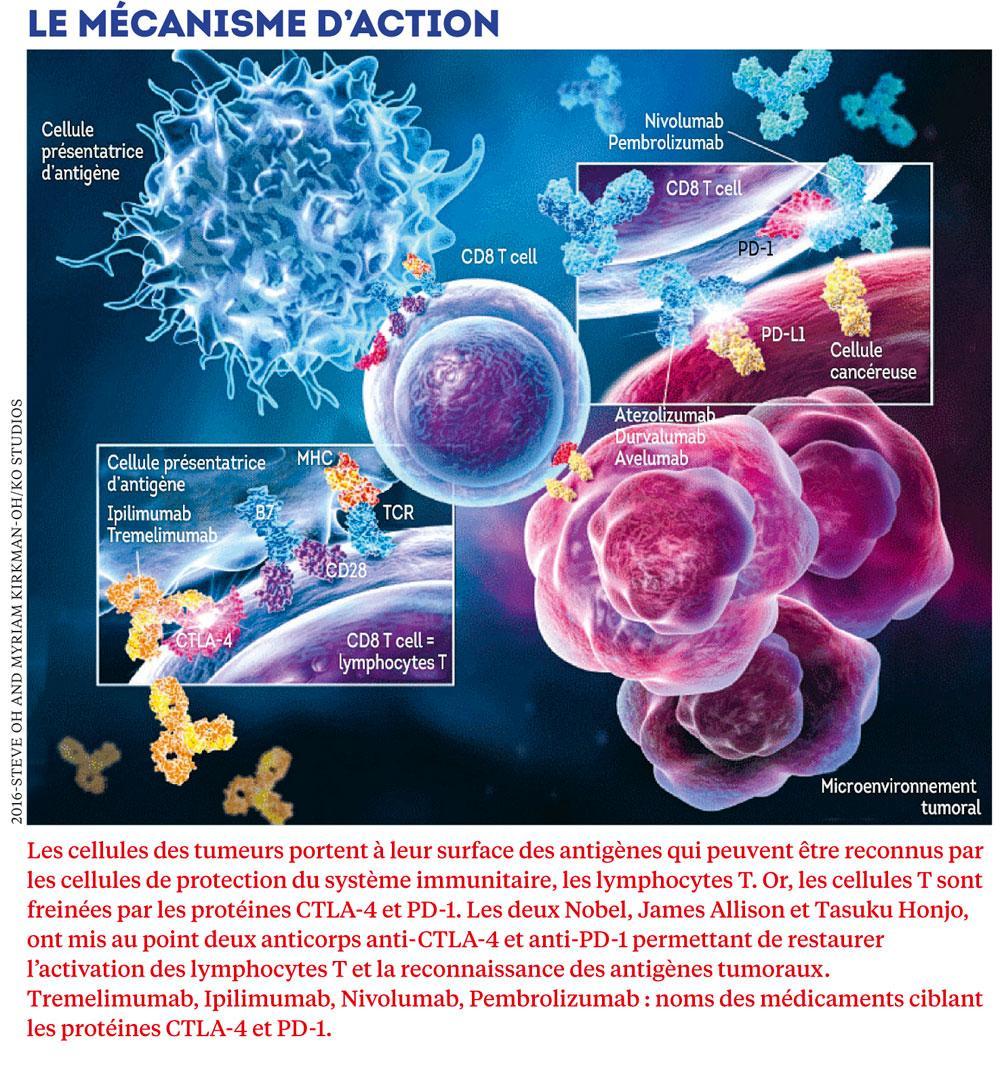
L’immunothérapie, » c’est réussir à stimuler les lymphocytes T ( NDLR : des globules blancs, soldats de l’immunité, produits dans la moelle osseuse) pour qu’ils aillent détruire la tumeur. Pour ça, il faut que les lymphocytes T détectent quelque chose sur la tumeur, et ce qu’ils y repèrent, c’est précisément un antigène, explique Jean-François Baurain, chef de clinique du centre du cancer à Saint-Luc. Il existe donc des antigènes spécifiques du cancer, qui sont identifiés par les lymphocytes T, lesquels sont capables d’induire une réponse immunitaire. Et c’est Thierry Boon qui a découvert cela. »
Le jury du Nobel aurait-il été si ingrat ? A l’époque, la découverte du professeur belge n’a pas créé l’étincelle qui aurait pu embraser le champ de la cancérologie. Le passage de la souris à l’homme n’avait d’ailleurs pas été concluant, et l’histoire a fini par l’oublier. » Surtout, les gens voient plutôt les médicaments qui sont donnés, qui peuvent à présent sauver la vie de patients. On veut récompenser ceux qui ont découvert les principes qui ont pu donner lieu à ces médicaments « , poursuit Jean-François Baurain.

Les techniques
Depuis toujours, les cancérologues ont cherché à lutter contre le cancer en s’attaquant directement aux cellules tumorales : il s’agissait de les éliminer ou de les détruire par la chirurgie, la radiothérapie et la chimiothérapie. En revanche, pour les malades porteurs de métastases, les médecins se trouvaient souvent démunis, avec des résultats très mitigés. Se fondant notamment sur les expérimentations de l’équipe du professeur Boon, les chercheurs ont alors raisonné de la sorte : » Puisque les cellules tumorales portent des antigènes qui permettent de les distinguer des cellules normales, on peut imaginer plusieurs façons de s’en servir. On peut chercher à induire une réponse du système immunitaire contre ces antigènes chez le patient lui-même ; on peut également administrer au patient des cellules capables de tuer ses cellules cancéreuses « , lit-on dans L’Immunothérapie des cancers. Histoire d’une révolution médicale, coécrit par Eric Vivier, professeur d’immunologie à l’université Aix-Marseille (1).
La première stratégie vise alors la mise au point d’un vaccin. On n’en dispose toujours pas. L’obstacle principal est qu’il existe de multiples formes de cancer. Il n’est donc, a priori, pas possible d’identifier une cible commune à tous les cancers contre laquelle diriger un éventuel vaccin. Des études sont notamment menées en Belgique. Thierry Pieters, oncologue et pneumologue à Saint-Luc, parle de recherches » de phase précoce « . Jusqu’ici, les résultats ne sont pas significatifs. En revanche, on sait que certains cancers ont des causes infectieuses. Par exemple, les virus de l’hépatite B et C sont retrouvés dans le cancer du foie. De même, les infections au papillomavirus sont directement impliquées dans le cancer du col de l’utérus. Une seule voie s’offre alors : vacciner contre les virus associés au cancer.
La seconde technique, injecter des cellules, c’est la » thérapie par cellules CAR-T « , consacrée en 2017, » avancée thérapeutique de l’année » par la puissante Asco. Elle consiste à prélever sur un patient ses lymphocytes T, à les cultiver in vitro, puis les modifier génétiquement de manière à leur faire exprimer un récepteur artificiel (le » CAR « ), une espèce de » super-radar » qui reconnaît spécifiquement l’antigène tumoral à neutraliser. Après un délai de plusieurs semaines, ces lymphocytes T sont réinjectés au patient, prêts à tuer les cellules tumorales. Son indication reste limitée à certains cancers du sang – la technologie n’a pas encore démontré son efficacité dans des cancers solides (c’est-à-dire des tumeurs d’organes) – mais pour lesquels l’effet chez certains patients est étonnant.

Une technologie infiniment plus modulable qu’un simple médicament, un jeu de Lego en quelque sorte. Mais le traitement demeure hypertoxique et risqué, entraînant des réactions rares mais très sévères. Il peut entraîner une libération intensive de cytokines, des molécules du système immunitaire qui stimulent l’activation des lymphocytes. Ce choc cytokinique peut provoquer des défaillances d’organes et des comas, mettant le pronostic vital en jeu. Sans compter son coût astronomique : le traitement, à partir des cellules du patient, s’élève à plus d’un million de dollars.
L’étincelle
Toutefois, » tout s’est accéléré lorsqu’on a compris que la tumeur déclenche des mécanismes très précis qui inactivent les processus de défense « , note Laurence Buisseret, oncologue et chercheuse à l’institut Jules Bordet. Autrement dit, le système immunitaire n’en fait pas assez pour combattre cet ennemi, parce qu' » il ne se réduit pas à une machine de guerre. Il fait aussi la paix « , explique Eric Vivier. En plongeant au coeur même de ses rouages, des chercheurs ont mis au jour que, à côté des molécules qui actionnent les lymphocytes T, d’autres molécules, au contraire, les entravent ou les éteignent : les lymphocytes T ne peuvent donc pas, ou alors trop tard, passer à l’attaque contre les cellules tumorales. » C’est d’abord une révolution conceptuelle. Cela revient à dire : le problème du cancer, ce n’est pas la cellule cancéreuse mais la tolérance du système immunitaire à l’égard des tumeurs « , résume Laurence Buisseret.
La donne a commencé à véritablement changer en 2010, quand, chacun de leur côté, James Allison et Tasuku Honjo vont réussir là où leurs prédécesseurs avaient échoué. Les deux immunologistes avaient été quelques années auparavant parmi les premiers à identifier deux protéines présentes à la surface des lymphocytes T, nommées PD-1 et CTLA-4, fonctionnant comme des freins à la réaction immunitaire du corps. Ils ont alors cette idée de génie : neutraliser ces freins pour libérer les défenses antitumorales. Beaucoup recourent à la métaphore automobile, pour mettre en lumière l’originalité de leurs travaux : appuyer plus fort sur l’accélérateur – soit stimuler directement la réponse immunitaire au cancer – ne sert à rien si on ne lâche pas le frein à main. C’est elle, l’étincelle qui va mettre le feu aux poudres et bousculer la longue histoire des cancers !
Même si, à l’époque, la majorité des scientifiques doutent de la faisabilité et de l’efficacité de leur stratégie, les deux chercheurs parviennent à élaborer des traitements dits » inhibiteurs de checkpoints « , des anticorps capables de bloquer l’action des protéines PD-1 et CTLA-4. » Il y aura alors un avant et un après. Une chose est sûre, on ne reviendra pas en arrière « , commente Mathijs Goossens, porte-parole de la Fondation contre le cancer.

Les premières victoires
En 2011, un premier médicament anti-CTLA-4, appelé ipilimumab, est approuvé aux Etats-Unis et en Europe. Puis, en 2014, plusieurs anticorps anti-PD-1 et anti-PD-L1 (une protéine présente sur les cellules tumorales qui se lie au récepteur PD-1) sont commercialisés. Plus faciles à administrer, injectés par intraveineuse toutes les deux à quatre semaines, ces traitements ont moins d’effets indésirables, mais ceux-ci peuvent être sévères. Dès lors qu’on déverrouille le système immunitaire, il risque, cette fois, d’en faire trop. Ces thérapies peuvent engendrer une réaction auto-immune et, partant, une attaque contre les tissus sains de l’organisme, en particulier la peau, le tube digestif, la thyroïde, mais aussi le foie et les poumons. » On observe que ces effets secondaires sévères ne concernent qu’un faible pourcentage des patients. Ces traitements restent généralement bien tolérés « , remarque Laurence Buisseret. Ici, d’ailleurs, pas de chute de cheveux, de nausées ou d’infections.
C’est une révolution équivalente à l’arrivée de la chimiothérapie dans l’histoire de la médecine.
Et voilà les premières victoires ! D’abord, chez des patients atteints d’un mélanome métastatique, un cancer cutané très agressif : jusqu’à un patient sur cinq est toujours en vie après cinq ans, et même un sur huit après dix ans pour les premiers traités par ipilimumab. Pratiquement une guérison. » Alors qu’avant 2010, le pronostic de ces patients à un stade avancé était fort sombre. Aucun traitement ne prolongeait l’espérance de vie, malheureusement fort raccourcie dans l’immense majorité des cas, se souvient Jean-François Baurain. Ces médicaments ont changé la vie de nos malades. Avec les anti-PD-1 et PD-L1, chez 30 % des patients traités en première ligne ( NDLR : avant d’autres thérapies), le mélanome n’évoluera plus jusqu’à cinq ans après le début du traitement. »

Ces molécules réduisent également le risque de rechute chez les patients opérés d’un mélanome envahissant les ganglions lymphatiques. Chez eux, on sait que la récidive se produit dans un cas sur deux. » Or, pour les patients traités par immunothérapie après la chirurgie durant dix-huit mois, le taux de survie sans rechute grimpe à 71,4 % « , soutient le professeur Baurain qui commence à oser prononcer le mot de » guérison » pour certains malades.
Dans les affections du poumon métastatique non à petites cellules (soit plus de 80 % des cas), des cancers réputés tueurs à court terme, le traitement s’est révélé remarquablement efficace, bien plus qu’une chimio. » Les dernières études observent une diminution de la mortalité de 50 %. C’est énorme pour une maladie qui touche environ 8 000 personnes par an en Belgique « , déclare Thierry Pieters. Publiées pour la première fois en 2018, les données de survie à cinq ans d’une centaine de patients admis dans une étude de phase 1 avec un anti-PD1 sont de 16 %, alors que les spécialistes attendaient seulement 6 %… Certaines combinaisons s’avèrent encore plus performantes. Ainsi quand l’immunothérapie est associée à la chimio dans les cancers de stade III (localement avancés et non opérables), les résultats sont inédits : » Nous avons de 25 à 30 % des patients en rémission cinq ans après le traitement. »
Des taux de réponses (2) prolongées s’observent aussi dans d’autres cancers en phase avancée, comme ceux du rein, de la vessie, les tumeurs ORL, le lymphome de Hodgkin (cancer du système lymphatique). Pour le rein, le taux de réponse (globale ou partielle) s’élève à 20 %. Au-delà, 35 % des » répondeurs » voient la maladie se stabiliser. Pour les cancers ORL, la survie à un an est doublée comparativement à la chimio, avec une meilleure tolérance. Et, dans les essais cliniques en cours, des résultats inattendus sont parfois observés. Dans les rechutes de cancers du sein » triple négatifs » (soit 15 % des tumeurs) particulièrement agressifs, l’immunothérapie associée à la chimio a montré une rémission de longue durée chez une femme sur six. En Belgique, l’institut Jules Bordet teste actuellement auprès de 150 malades la combinaison des deux médicaments à un stade métastatique. » Avec ces nouvelles molécules, nous notons une réponse efficace chez des patients dont le pronostic était engagé. D’où cette interrogation : l’immunothérapie pourrait-elle fonctionner à un stade plus précoce (sans métastase) et donc diminuer le risque de rechute, comme cela a été démontré dans les cancers de la peau et du poumon ? » relève Laurence Buisseret.

Les limites
Les oncologues ont pourtant parfaitement conscience des limites actuelles de l’immunothérapie. Tous cancers confondus, en moyenne, seulement 20 % des patients répondent au traitement. Si elle apporte un bénéfice à plus de la moitié des patients atteints d’un mélanome, elle obtient des résultats peu convaincants sur des types de cancers aussi fréquents que ceux du sein, du côlon, de la prostate. » Il faut distinguer les tumeurs « chaudes » et les tumeurs « froides », signale Laurence Buisseret. Les tumeurs chaudes sont plus susceptibles de stimuler notre système immunitaire, parce qu’elles produisent beaucoup de protéines anormales que le système peut plus facilement détecter et attaquer. Elles sont le plus souvent des tumeurs cancérigènes liées à l’environnement : mélanomes (soleil), poumon ou vessie (tabagisme). A l’inverse, les tumeurs froides sont dues à des mutations génétiques et ne génèrent pas la même quantité de protéines inhabituelles. Or, les cancers qui résistent à l’immunothérapie sont précisément des tumeurs froides. »
Aujourd’hui, ces traitements sont déjà accessibles et remboursés en Belgique dans six cancers différents (mélanome, poumon, vessie, Hodgkin, rein, ORL). Ce qui représente 5 000 patients en 2017, 9 000 en 2018 et 11 000 en 2019 – ces chiffres, datant de 2017, devant être nuancés pour les deux dernières années, puisqu’ils sont probablement plus élevés. Selon les spécialistes, c’est l’un des points à souligner : la Belgique se montre particulièrement à la pointe de l’innovation en oncologie. Elle figure d’ailleurs parmi les rares Etats européens où les lenteurs et les contraintes réglementaires qui retardent la distribution de ces traitements ont été vite levées. Concrètement, dès que l’Autorité européenne du médicament approuve un traitement d’immunothérapie, il est immédiatement à disposition des patients belges. Exit donc le passage devant la commission de remboursement de l’Inami, qui met en moyenne un an à se prononcer sur le prix.
D’autres patients ont accès aux traitements à travers les essais cliniques. Cependant, cela dépendrait du centre dont relève le patient et du » réseau » du soignant. » Par manque d’informations, il est difficile de savoir quel hôpital réalise quel essai clinique. Il n’existe en effet pas encore de « centrale » qui permettrait de guider les patients vers les hôpitaux en fonction de leurs essais cliniques dans tel ou tel type de cancer « , épingle Mathijs Goossens.
Les défis
Pour Thierry Pieters, l’immunothérapie a conduit à revoir les schémas de soin. Ainsi, dans son unité, le standard de traitement du cancer du poumon associe à présent la chimio et l’anticorps PD-1. Dans les traitements contre le mélanome, elle a complètement supplanté la chimiothérapie : » Tout l’effort de ces prochaines années sera de tester des combinaisons thérapeutiques. La chimiothérapie ne disparaîtra pas. En revanche, la combiner à l’immunothérapie améliore de loin la survie du patient, surtout si l’administration se fait plus précocement. Au sein des praticiens, on voit arriver un mouvement de plus en plus important pour la prescrire plus tôt, dans des stades opérables, par exemple, et plus seulement dans des états avancés ou métastasés comme c’est le cas aujourd’hui, en deuxième ou troisième ligne, après l’échec d’une chimio ou d’une autre thérapie. »
Jusqu’où ira cette révolution ? Actif contre plusieurs cancers, jamais un édicament antitumoral n’avait eu un spectre aussi large. Le coût est très régulièrement pointé, s’élevant à environ 8 000 euros par mois par patient. » La première urgence est de comprendre pourquoi jusqu’à 80 % des patients ne répondent pas à ces traitements « , enchaîne Laurence Buisseret. Qu’ont-ils de plus, ou de moins, qui pourrait expliquer cette inégalité ? C’est une énigme qui suppose la découverte de biomarqueurs dans le sang ou les tissus, qui permettraient de prédire l’efficacité du traitement chez un malade donné.
Les études en cours cherchent aussi d’autres éventuelles molécules qui freinent le système immunitaire, fonctionnant sur le même mode que CTLA-4 et PD-1. Reste à voir si elles peuvent, elles aussi, être levées. Les chercheurs s’attachent encore à tenter de transformer des tumeurs froides en tumeurs chaudes, pour les rendre plus vulnérables à l’immunothérapie. D’autres recherches consistent à associer plusieurs de ces traitements pour aboutir à des combinaisons plus judicieuses et plus efficaces. » Nous sommes au tout début de l’aventure. Elle est en train de s’écrire. C’est une révolution équivalente à l’arrivée de la chimiothérapie dans l’histoire de la médecine « , conclut Jean-François Baurain.
L’espoir qu’elle porte boostent les chercheurs et pousse l’industrie pharmaceutique, où règne une compétition âpre, à investir lourdement. En 2018, selon un décompte de l’Asco, il y avait quelque 3 000 essais cliniques en cours dans le monde et plus de 30 médicaments en développement. Du jamais-vu sur une période aussi courte. Ainsi certains disent craindre l’explosion d’une » bulle » intellectuelle et industrielle liée à l’immunothérapie. » L’enthousiasme est si fort qu’en congrès, glisse l’un de nos interlocuteurs, il n’est pas rare d’entendre que bientôt, nous aurons plus d’études, parfois pensées à la hâte, que de patients à sauver… »
(1) L’Immunothérapie des cancers. Histoire d’une révolution médicale, par Eric Vivier et Marc Daëron, Odile Jacob, 2019, 250 p.
(2) La maladie est dite » stable » lorsque la tumeur n’évolue pas, ni dans un sens ni dans l’autre. On parle de » réponse » quand le traitement agit efficacement sur la tumeur, soit en freinant ou stoppant sa progression, soit en diminuant son volume. Une réponse est dite complète lorsque plus aucune trace de la tumeur n’est détectée par les examens. Contrairement à une rémission complète, une réponse complète au traitement ne veut pas dire guérison du cancer.

