L’été dernier à Nashville, une mère de famille américaine s’est fait modifier le génome et a cessé de souffrir. « Depuis mes 11 ans, j’espérais une guérison », écrit Victoria Gray, 34 ans, à l’AFP. « Depuis que j’ai reçu les nouvelles cellules, j’ai retrouvé le plaisir de passer du temps en famille sans vivre dans la crainte de douleurs ou d’une urgence ».
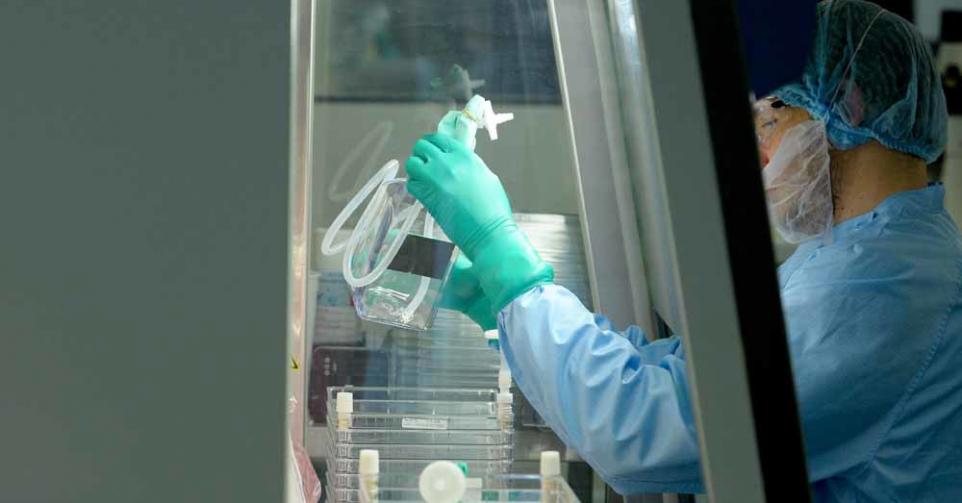
Victoria a une maladie génétique du sang, la drépanocytose, qui provoque d’atroces crises. Elle a participé à un traitement expérimental. Sur plusieurs semaines, on lui a prélevé son sang, avant d’en extraire les cellules à l’origine de son mal : les cellules-souches qui logent dans la moelle osseuse et fabriquent les globules rouges – des globules qui sont déformés chez Victoria, provoquant les crises.
Ces cellules-souches ont été expédiées dans un laboratoire écossais, où leur ADN a été modifié grâce à un nouvel outil appelé Crispr/Cas9 (prononcer: « crispeur »), et surnommé ciseaux moléculaires. Puis, on lui a retransfusé les cellules modifiées génétiquement… qui sont retournées au bercail, dans la moelle osseuse. « Miracle », dit Victoria: au bout d’un mois, celle-ci produisait des globules normaux.
On ignore si la réparation durera. Mais en théorie, elle est guérie pour la vie.
« Il s’agit d’une seule patiente, c’est encore tôt », dit son médecin, Haydar Frangoul, du centre anticancéreux Sarah Cannon, à Nashville. « Mais ces résultats sont formidables ».
En Allemagne, une femme de 19 ans a été soignée avec la même méthode pour une autre maladie du sang, la bêta-thalassémie. Elle avait auparavant besoin de 16 transfusions sanguines annuelles. Neuf mois après, elle en était libérée.
On modifie l’ADN du vivant depuis des décennies, comme le maïs ou le saumon OGM en témoignent. Y compris pour les humains dans des essais thérapeutiques pour ces mêmes maladies du sang et d’autres, avec des techniques plus anciennes.
Mais Crispr, inventé en 2012, a démocratisé la pratique car il est plus simple que les technologies précédentes, moins cher, et utilisable dans de petits laboratoires. Et c’est parce qu’il est facile d’emploi qu’il a relancé les fantasmes sur la manipulation du vivant.
« Tout va très vite », dit à l’AFP la codécouvreuse de Crispr, la généticienne français Emmanuelle Charpentier, cofondatrice de Crispr Therapeutics, la société qui réalise ce premier essai clinique.

– 2019, année de percées –
Crispr est une révolution, mais encore expérimentale.
Elle ne doit pas cacher que l’année 2019 a marqué un tournant historique dans une aventure commencée il y a trois décennies: la thérapie génique devient une réalité.
Pour la première fois, des thérapies géniques ont obtenu un feu vert à la commercialisation pour une maladie neuromusculaire qui condamnait les bébés à une mort précoce (aux Etats-Unis) et pour une maladie du sang (dans l’Union européenne). Au total, il y a désormais huit thérapies géniques mises sur le marché dans le monde, en majorité contre des cancers et notamment une contre une forme de cécité.
La thérapie génique consiste à insérer un gène normal dans les cellules qui ont un gène défaillant, comme un cheval de Troie, afin qu’il fasse le travail que le mauvais gène ne fait pas: fabriquer des globules rouges normaux, par exemple, ou dans le cas d’un cancer, fabriquer de super-globules blancs qui tuent les tumeurs.
Crispr va plus loin. Au lieu d’ajouter un gène nouveau dans les cellules, l’outil modifie le gène défaillant existant.
Les Français se souviennent peut-être du premier Téléthon, en décembre 1987, au profit des enfants atteints de myopathies, des maladies musculaires. Sept des huit médicaments-gènes autorisés aujourd’hui, après des années d’essais cliniques, sont liés directement ou indirectement à la recherche lancée par le Téléthon et son laboratoire, le Généthon.
A Paris, Serge Braun, le directeur scientifique du Téléthon, dont la 33e édition vient de se tenir, voit 2019 comme une année charnière, prélude à une révolution médicale.
« Vingt-cinq, trente ans, c’est le temps », dit-il à l’AFP. « Cela prend toujours une génération, la thérapie génique n’y a pas échappé. Maintenant, elle va crescendo ».
Près de Washington, au sein des Instituts américains de santé, on célèbre également une « période de percées ».
« On a atteint un point d’inflexion », dit à l’AFP la secrétaire générale Carrie Wolinetz.
Le problème est que ces thérapies nouvelles sont hors de prix: jusqu’à un voire deux millions de dollars, forçant de pénibles négociations avec les assureurs. Elles exigent aussi une lourde technique, donc sont restreintes aux pays riches.
Victoria Gray a ainsi passé des mois à l’hôpital, entre les prises de sang, une chimiothérapie pour nettoyer la moelle osseuse, la greffe par perfusion, et une hospitalisation finale d’un mois… Sans compter un sepsis, une infection.
« On ne peut pas faire ça dans l’hôpital du coin », pointe son médecin.
Reste que le nombre de thérapies géniques autorisées passera à une quarantaine d’ici à 2022, selon des chercheurs du MIT, pour des cancers et maladies des muscles, du système nerveux, de l’oeil… La Chine, notamment, a de nombreux essais en cours.
– Apprentis sorciers –
La simplicité de Crispr a dopé l’imagination des apprentis sorciers.
En Chine l’an dernier, un scientifique, He Jiankui, a modifié avec Crispr des embryons lors d’une fécondation in vitro, qui sont devenus les jumelles Lulu et Nana, provoquant sa mise au ban de la communauté scientifique internationale.

Il voulait créer une mutation immunisant contre le virus du sida (sans nécessité apparente), mais a provoqué d’autres mutations par inadvertance… qui seront transmissibles à leurs descendants.
« La technologie n’est pas encore sûre », dit Kiran Musunuru, professeur de génétique à l’université de Pennsylvanie. Les ciseaux Crispr coupent souvent à côté du gène ciblé. « C’est facile à utiliser si on se fiche des conséquences ».
Mais l’autodiscipline éthique semble prévaloir. Même si un Russe, Denis Rebrikov, envisage d’utiliser Crispr pour aider des parents sourds à avoir des enfants sans le handicap.
Pour les animaux, la tentation est de modifier le génome d’espèces entières : les moustiques du paludisme pour les décimer (Burkina Faso); ou les souris hôtes des tiques de la maladie de Lyme (Etats-Unis). Leurs concepteurs avancent prudemment, conscients de l’imprévisibilité des réactions en chaîne sur l’écosystème.
Emmanuelle Charpentier ne croit pas aux prédictions les plus sombres.
Les « biohackers » américains qui s’injectent du Crispr acheté sur internet? « Tout le monde n’est pas biologiste ou scientifique », balaie-t-elle.
Et un détournement militaire pour créer des virus tueurs de soldats ou des bactéries qui ravageraient l’agriculture de l’ennemi? « Je suis bactériologiste, cela fait des années qu’on parle de bioterrorisme », philosophe-t-elle. « Néanmoins, cela ne s’est jamais produit ».
Elle reste persuadée que la technologie tend à être utilisée pour le meilleur et qu’en substance, l’avenir apportera plus de Victoria que de Lulu et Nana.