Imprimer du vivant en 3D, une technique en plein essor

Produire de la peau, de l’os, des vaisseaux et même des miniorganes à la demande ? A Bordeaux, des équipes de pointe travaillent sur la « bio-impression 3D ».
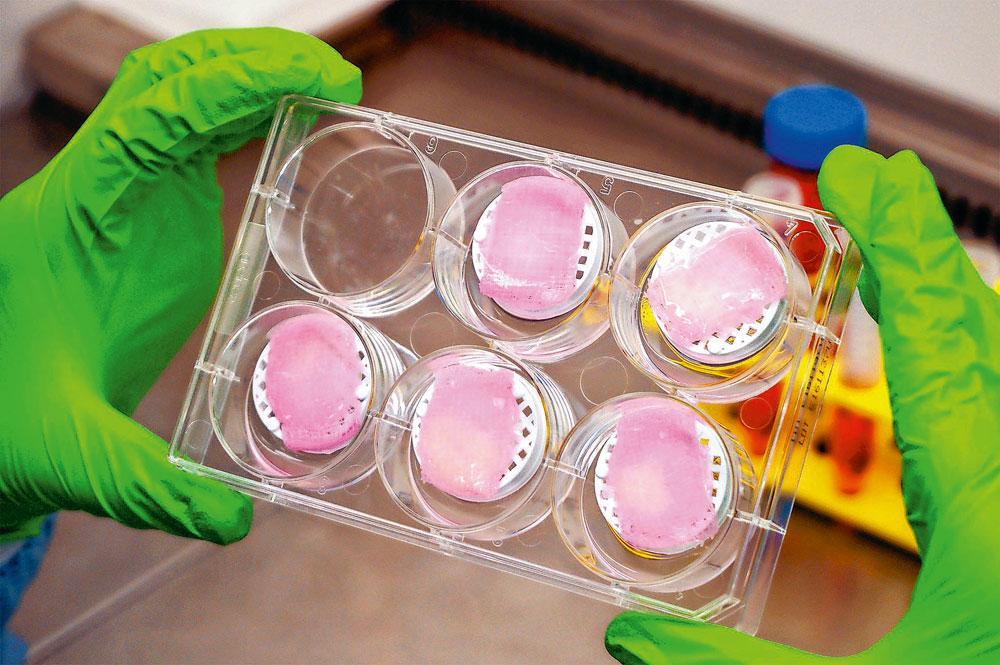
Gants, charlotte, surchaussures, blouse. Pour pénétrer dans le laboratoire de la start-up Poietis, dans la banlieue de Bordeaux, il faut montrer patte blanche : rien ne doit polluer l’atmosphère stérile des lieux. Car ici, on imprime… de la peau humaine ! Avec d’infinies précautions, Fabien Guillemot, le cofondateur de la société, sort d’une étuve une boîte contenant six petits disques gélatineux et rosâtres posés sur des compresses stériles. Pas de poils, de glandes sudoripares ou de vascularisation, mais du derme et de l’épiderme superposés, semblables à ceux de notre enveloppe. » Il s’agit des tout premiers échantillons de tissus humains « bio-imprimés » destinés à être commercialisés, s’enthousiasme cet ancien chercheur de l’Institut national de la santé et de la recherche médicale (Inserm). Ces lots seront prochainement expédiés à des laboratoires pharmaceutiques et à des industriels de la cosmétique, qui en finiront ainsi avec les tests sur les animaux. » Même s’ils ne peuvent pas encore être greffés sur des patients, ces quelques centimètres carrés marquent le début d’une révolution : ils représentent la preuve vivante que la bio-impression – de peau aujourd’hui, de foie, de muscles ou de pancréas peut-être un jour – passe peu à peu de la science-fiction à la réalité.
La fabrication à la demande d’organes mobilise aujourd’hui de plus en plus de chercheurs à travers le monde. Notamment en Chine ou en Corée, et surtout aux Etats-Unis, où un consortium soutenu par le département de la Défense prévoit d’investir 300 millions de dollars dans ce domaine. En France, l’Inserm a ouvert un » accélérateur de recherche technologique » dédié à la bio-impression, également à Bordeaux, avec pour mission de diffuser au sein de la communauté scientifique française cette technique prometteuse mais encore émergente. En Belgique, plusieurs spin-off et chercheurs travaillent sur des méthodes de reconstruction des tissus, mais pas grâce à l’impression 3D. Une technique qui » ne peut se cantonner qu’à des structures de très petites tailles et ne peut donc nous être utile pour l’instant « , estimait Jérôme Duisit, médecin-assistant en chirurgie plastique à l’UCL, spécialisé en reconstruction faciale, sur le site ScienceToday. De quoi s’agit-il ? Pour le comprendre, il faut se diriger vers l’imprimante laser installée dans le laboratoire de Poietis. La machine, sorte de frigo américain taille XXL, cache un véritable concentré de technologie. Sur le principe de l’impression en 3D, technique désormais assez courante dans l’industrie ou dans le monde médical pour la production de prothèses sur mesure, l’imprimante vient déposer couche après couche un matériau pour fabriquer des objets en trois dimensions. Sauf qu’ici il ne s’agit pas de plastique, de résine ou de métal, mais de cellules vivantes.
Récupérées auprès de cliniques ou d’hôpitaux après des opérations, les cellules de l’épiderme (kératinocytes) et du derme (fibroblastes) sont d’abord multipliées in vitro. Puis vient l’impression proprement dite. Le derme d’abord : les fibroblastes mélangés à leur milieu de culture forment une » bio-encre « . Etalé sur une fine plaque de verre placée dans l’imprimante, ce liquide est projeté sous forme de microgouttelettes par une impulsion laser sur du collagène, selon un motif précis. Une dizaine de couches sont ainsi superposées puis placées quelques jours dans une étuve, avant de répéter l’opération avec les kératinocytes. » Le choix du motif d’impression, c’est-à-dire du positionnement des cellules, est essentiel : cela va leur permettre de s’organiser au mieux pendant la phase de maturation, où elles forment petit à petit le tissu souhaité « , souligne Fabien Guillemot. Un processus biologique d’autant plus fascinant que ses mécanismes demeurent encore mystérieux. Mais le résultat est là : en deux semaines à peine, les centaines de milliers de cellules imprimées recréent de la peau.
Chacune de ces étapes a demandé des années de recherche : trouver la source de cellules la plus adaptée, le bon milieu de culture, le dessin optimal de l’impression… Sans parler de la conception de la machine elle-même, qui doit beaucoup à l’écosystème scientifique bordelais, en pointe dans la photonique et les technologies laser. Mais Fabien Guillemot ne compte pas s’arrêter là. Même si la concurrence est rude, avec deux autres start-up en France et en Espagne sur le créneau, il espère bien être le premier à faire entrer son invention au bloc opératoire, pour traiter les grands brûlés et les plaies chroniques. Pour cela, ses équipes devront d’abord montrer qu’il est possible, pour éviter les rejets, d’imprimer de la peau en cultivant les propres cellules des patients, même si elles ne sont par définition pas standardisées, contrairement à celles utilisées aujourd’hui. Il leur faudra aussi augmenter la taille des morceaux imprimés, et bien sûr passer toutes les étapes des essais cliniques. » Nous y parviendrons d’ici trois à cinq ans « , assure Fabien Guillemot.
Qu’en est-il de l’impression 3D d’autres organes ? Différentes équipes de recherche, aux Etats-Unis notamment, ont multiplié récemment les annonces spectaculaires. Impression de cellules du foie en 2014, de cartilage d’oreille, de fibres musculaires et d’os en 2016. Et l’an dernier, de tissu ovarien, greffé avec succès sur une souris qui a ensuite mis bas… » Il s’agissait à chaque fois soit d’expériences préliminaires sur les animaux, soit d' » organoïdes « , des organes proches des nôtres mais dont la taille ne dépasse pas pour la plupart quelques centaines de micromètres « , relativise le chercheur Jean-Christophe Fricain, responsable de l’accélérateur de recherche technologique de l’Inserm à Bordeaux. Rien, donc, qui laisse espérer des greffes chez l’homme à court ou moyen terme. Ces micro-organes bio-imprimés serviront néanmoins eux aussi à tester la toxicité et l’effet de médicaments. Outre-Atlantique toujours, la société Organovo met déjà à disposition dans ses locaux des tissus de foie, dans le cadre de prestations de services pour le compte de l’industrie pharmaceutique. A Bordeaux, les chercheurs travaillent également à la fabrication de foies et de pancréas. » L’avantage de la bio-impression tient surtout dans l’organisation des cellules, qui aboutit à des organoïdes toujours identiques, ce qui n’est pas le cas avec les technologies concurrentes, comme la culture in vitro de cellules souches « , souligne Jean-Christophe Fricain.
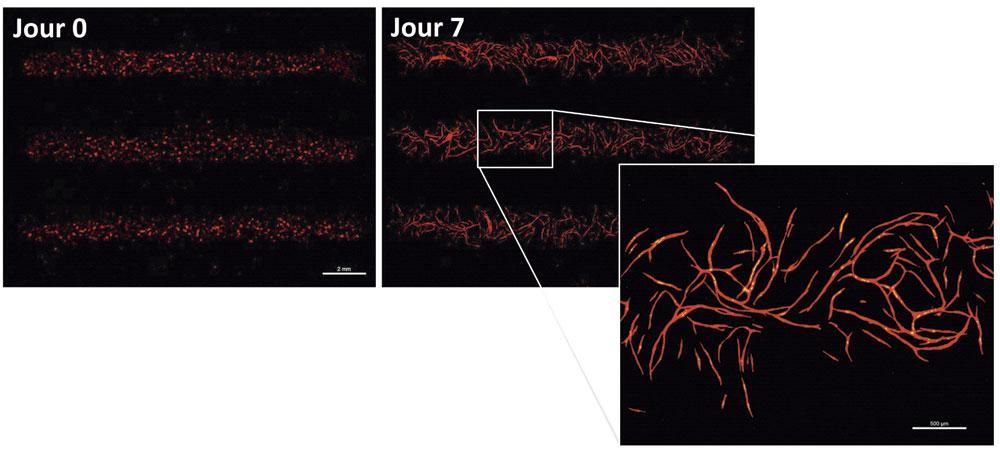
Mais dans les étuves de son laboratoire se trouvent surtout des morceaux de vaisseaux de quelques centimètres, eux aussi bio-imprimés. Crucial. Car si la fabrication de tissus de plus grande taille ne semble pas à terme un problème insurmontable, l’un des freins à d’éventuelles transplantations demeure l’absence de vascularisation des organes bio-imprimés. » Pour obtenir un organe fonctionnel, les cellules doivent bénéficier d’un apport constant en oxygène et en nutriments. Sinon, elles meurent très vite « , précise le chercheur. Pour s’attaquer à ce verrou technologique, son laboratoire dispose de tous les types de bio-imprimantes existantes (laser, jet d’encre et extrusion). » Chacune offre une résolution différente, le laser étant le plus précis, et l’extrusion permettant d’imprimer des volumes plus importants « , explique Hugo de Oliveira, le coordinateur scientifique de la structure. Déjà, des veines fonctionnelles de différente taille ont été produites à partir de cultures de cellules souches issues du sang de cordons ombilicaux. Reste maintenant à les imprimer ensemble, en espérant qu’elles forment alors spontanément un réseau sanguin complet. Puis, il faudra encore les relier aux organes…
Là aussi, la nature pourrait venir en aide à ces artisans du vivant. En imprimant des cellules » in situ « , c’est-à-dire directement dans l’organisme (en l’occurrence celui de souris), les chercheurs bordelais ont montré que le corps servait de bioréacteur naturel : en 2016, ils ont pu régénérer l’os crânien d’un rongeur. » Nous venons de renouveler l’expérience, avec à la fois des cellules d’os et de capillaires sanguins, pour voir si l’ensemble se connecte plus facilement quand il est imprimé à l’intérieur de l’animal « , raconte Olivia Kérourédan, chargée de cette expérimentation. Les résultats seront connus dans quelques semaines, mais, même si cette technique fait ses preuves, il faudra encore de nombreux développements pour qu’elle s’applique un jour à l’homme. La bio- impression d’organes ne semble donc pas pour demain… Mais peut-être pour après- demain.
Par Stéphanie Benz.
2003 : premiers projets avec des imprimantes à jet d’encre au Japon et aux Etats-Unis.
2006 : prototype de bio-imprimante par laser, en France (Inserm, Bordeaux).
2007 : création de la première start-up de bio-impression (Organovo, Etats-Unis).
2010 : impression d’os in vivo chez la souris, en France (Inserm, Bordeaux).
2014 : impression d’un « organoïde » de foie de quelques microns et de vaisseaux sanguins (Etats-Unis, Australie).
2015 : impression de peau par Poietis (France).
2016 : impression de cartilage d’oreille et de muscle au Wake Forest Institute (Etats-Unis).
2017 : impression de tissu ovarien chez la souris (Etats-Unis).
Cultiver des organes humains à l’intérieur d’animaux : voilà une des autres pistes à l’étude pour pallier le manque de greffons. Une équipe de Stanford a réussi à introduire des cellules souches humaines dans des embryons de mouton, en vue d’y faire » pousser » un pancréas. Pour l’instant, le processus reste peu efficace, avec seulement une cellule humaine pour 10 000 cellules de mouton : pour qu’un organe apte à une transplantation se développe, il en faudrait au minimum 1 %. Ce type de recherche, interdite aujourd’hui en France, pose de nombreuses questions : risque de voir migrer des virus animaux chez le patient greffé ; crainte que l’animal n’acquière des caractéristiques humaines si les cellules souches migraient vers son cerveau ; respect de la frontière homme-animal… Autant de sujets à l’agenda des états généraux de la bioéthique en cours jusqu’à l’été.
Vous avez repéré une erreur ou disposez de plus d’infos? Signalez-le ici