Essais cliniques : pour qui, pourquoi ?
En participant à un essai clinique en tant que patient ou volontaire sain, vous pouvez apporter votre contribution au développement de nouveaux médicaments et thérapies.
Faits et chiffres
Environ 170.000 Belges, en bonne santé ou malades, se portent volontaires chaque année pour participer à des essais cliniques, apportant ainsi leur contribution à la recherche. En 2016, on dénombrait dans notre pays 1399 essais cliniques en cours et 506 nouvelles demandes, plaçant la Belgique à la 2e place du classement européen en termes de nombre d’études par habitant, juste derrière le Danemark (source : pharma.be et AFMPS).
L’industrie pharmaceutique initie environ 80 % des essais cliniques réalisés dans notre pays, principalement pour tester de nouveaux médicaments. Le coût du développement d’un médicament (environ un milliard et demi d’euros) est en effet rarement à la portée d’organisations non commerciales. Les hôpitaux et les universités organisent toutefois des études cliniques propres, par exemple pour tenter d’améliorer la qualité d’une méthode thérapeutique existante. De nombreux hôpitaux participent évidemment aussi aux essais cliniques sur des médicaments organisés par les firmes pharmaceutiques, puisque c’est chez eux que se trouvent les patients.
En quatre phases
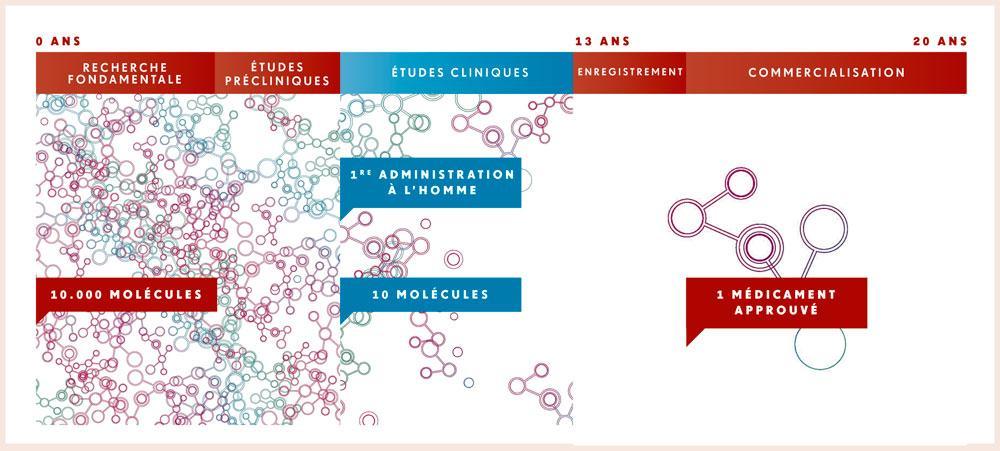
Pour espérer accéder à l’enregistrement, le candidat-médicament doit être soumis à des essais cliniques. Ils se déroulent en quatre phases.
En phase I, le candidat-médicament ou traitement d’étude est testé chez quelques douzaines de volontaires sains ; la dose est augmentée progressivement jusqu’à l’apparition d’effets biologiques perceptibles. À ce stade, les investigateurs cherchent à déterminer si le produit est bien supporté et comment il est assimilé, dégradé et éliminé par l’organisme.
Les effets thérapeutiques potentiels ne peuvent évidemment être observés que chez les malades. Souvent, on s’efforce déjà de s’en faire une idée chez une poignée de patients vers la fin de la phase I. L’efficacité et la sécurité du traitement d’étude seront ensuite explorés de manière approfondie auprès de quelques centaines de patients au cours de la phase II des essais cliniques, puis confirmées au cours de la phase III auprès de quelques milliers.
Lorsque la phase III se clôture avec succès, soit 12 à 14 ans après la découverte de la nouvelle molécule, les résultats sont soumis aux autorités chargées de l’enregistrement des médicaments. Si celles-ci donnent leur feu vert, une demande de prix et de remboursement sera soumise au gouvernement, après quoi le médicament pourra être mis sur le marché. Après sa commercialisation, son efficacité et sa sécurité seront suivies à l’échelon mondial et sur le long terme au cours de la phase IV.
Vous avez repéré une erreur ou disposez de plus d’infos? Signalez-le ici